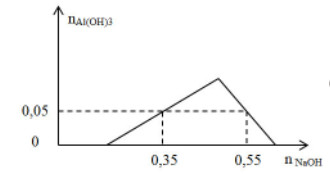
Chất X có chứa các ion x mol H+, y mol Al3+, z mol SO42- và 0,1 mol Cl-. Khi nhỏ từ từ đến dư dung dịch NaOH vào dung dịch X. Kết quả thí nghiệm được biểu diễn trên đồ thị sau:
Cho 300 ml dung dịch Ba(OH)2 0,9M tác dụng với dung dịch X thu được kết tủa Y và dung dịch Z. Khối lượng kết tủa Y là (các phản ứng xảy ra hoàn toàn):
Suy nghĩ và trả lời câu hỏi trước khi xem đáp án
Lời giải:
Báo saiTại điểm A: khi nNaOH = 0,35 mol: kết tủa chưa đạt cực đại
Do đó: nOH- = nH+ + 3.nAl(OH)3 → 0,35 = x + 3.0,05 → x = 0,2
Tại điểm B: khi nNaOH = 0,55 mol: kết tủa đang tan một phần:
Khi đó: nOH- = nH+ + 4.nAl3+ - nkết tủa → 0,55 = 0,2 + 4.y - 0,05 → y = 0,1 mol
Áp dụng định luật bảo toàn điện tích với dung dịch X: x + 3y = 2z + 0,1 → z = 0,2 mol
Ta có: nBa(OH)2 = 0,3.0,9 = 0,27 mol
Ba2++ SO42- → BaSO4 ↓
0,27 0,2 0,2 mol → nBaSO4 = 0,2 mol
Mặt khác khi đó nOH- = 0,54 mol → nOH- = nH+ + 4.nAl3+ - nkết tủa → 0,54 = 0,2 + 4.0,1 - nkết tủa
→nkết tuả = 0,06 mol = nAl(OH)3
Vậy kết tủa Y gồm có 0,2 mol BaSO4 và 0,06 mol Al(OH)3 → mY = 0,2.233 + 0,06.78 = 51,28 gam.