Đề thi giữa HK2 môn Hóa học 10 năm 2022
Trường THPT Ngô Quyền
-
Câu 1:
Cho FeS tác dụng với dung dịch H2SO4 loãng, thu được khí A; nếu dùng dung dịch H2SO4 đặc, nóng thì thu được khí B. Dẫn khí B vào dung dịch A thu được rắn C. Các chất A, B, C lần lượt là:
A. H2, H2S, S.
B. H2S, SO2, S.
C. H2, SO2, S.
D. O2, SO2, SO3.
-
Câu 2:
Để nhận biết dung dịch H2SO4 và dung dịch HCl người ta dùng
A. CuCl2.
B. NaNO3.
C. MgSO4.
D. BaCl2.
-
Câu 3:
Vị trí của nguyên tố oxi trong bảng tuần hoàn hóa học là
A. ô thứ 8, chu kì 3, nhóm VIA
B. ô thứ 8, chu kì 2, nhóm VIA
C. ô thứ 16, chu kì 3, nhóm VIA
D. ô thứ 16, chu kì 2, nhóm VIA
-
Câu 4:
Sục Cl2 vào nước, thu được nước clo màu vàng nhạt. Trong nước clo có chứa các chất là
A. Cl2, H2O
B. HCl, HClO
C. HCl, HClO, H2O
D. Cl2, HCl, HClO, H2O
-
Câu 5:
Đơn chất vừa có tính oxi hóa vừa có tính khử là
A. F2
B. O3
C. S
D. O2
-
Câu 6:
Ion X2- có cấu hình electron lớp ngoài cùng là 2s22p6. X là nguyên tố nào sau đây?
A. Oxi
B. Lưu huỳnh
C. Clo
D. Flo
-
Câu 7:
Clorua vôi có công thức là:
A. CaCl2.
B. CaOCl.
C. CaOCl2.
D. Ca(OCl)2.
-
Câu 8:
Chất có khả năng ăn mòn thủy tinh SiO2 là
A. H2SO4
B. Mg.
C. NaOH.
D. HF.
-
Câu 9:
Cho các chất rắn sau: Cr2O3, Fe(NO3)2, Al(OH)3, Mg. Số chất tan được trong dung dịch HCl loãng nguội (dư) là
A. 1
B. 2
C. 3
D. 4
-
Câu 10:
Dung dịch NaCl bị lẫn NaI. Để làm sạch dung dịch NaCl có thể dùng:
A. AgNO3.
B. Br2.
C. Cl2.
D. Hồ tinh bột.
-
Câu 11:
Hệ số của O2 trong phương trình: H2S + O2 → H2O + SO2 là bao nhiêu?
A. 1
B. 2
C. 3
D. 4
-
Câu 12:
Trong nhóm halogen, sự biến đổi tính chất nào sau đây của đơn chất đi từ flo đến iot là đúng ?
A. Ở điều kiện thường, trạng thái tập hợp chuyển từ thể khí sang thể lỏng và rắn
B. Màu sắc nhạt dần
C. Nhiệt độ nóng chảy giảm đân
D. Tính oxi hóa tăng dần
-
Câu 13:
Đốt cháy đơn chất X trong oxi thu được khí Y. Mặt khác, X phản ứng với H2 (khi đun nóng) thu được khí Z. Trộn hai khí Y và Z thu được chất rắn màu vàng. Đơn chất X là:
A. lưu huỳnh.
B. cacbon.
C. photpho.
D. nitơ.
-
Câu 14:
Cho các chất sau: Cl2, H2, Fe(OH)2, CO2, SO2, Ag, Fe, Na. Oxi không thể phản ứng được với
A. Cl2, CO2, Ag.
B. CO2, Ag.
C. Ag.
D. Cl2, CO2, SO2, Ag.
-
Câu 15:
Thực hiện thí nghiệm điều chế clo theo sơ đồ sau:
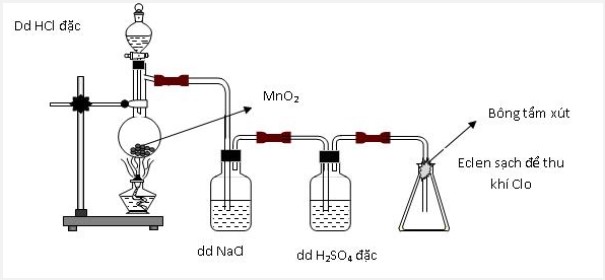
Cho các nhận định sau:
(a) Bình chứa dung dịch NaCl dùng để giữ khí HCl.
(b) Bình chứa dung dịch H2SO4 đặc để giữ hơi nước.
(c) Bông tẩm dung dịch xút có thể thay bằng tẩm nước.
(d) Có thể thay chất rắn trong bình cầu thành thuốc tím.
Số nhận định chính xác là:
A. 1
B. 2
C. 3
D. 4
-
Câu 16:
Cho axit H2SO4 đặc, dư tác dụng vừa đủ với 29,25 gam NaCl đun nóng. Khí thu được hòa tan vào 73 gam H2O. Nồng độ phần trăm của HCl trong dung dịch thu được là
A. 20%
B. 25%
C. 23,5%
D. 22%
-
Câu 17:
Nung m gam hỗn hợp KClO3 một thời gian thu được hỗn hợp chất rắn trong đó phần trăm khối lượng của oxi là 9,6%, của KCl là 74,5%. Phần trăm KClO3 bị phân hủy là:
A. 96,75%
B. 90%
C. 88%
D. 95%
-
Câu 18:
Cho V lít khí Cl2 (đktc) vào dung dịch chứa 30gam NaI và 30,9 gam NaBr. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch Y. Cô cạn dung dịch Y thu được 33,7 gam muối khan Z. Giá trị của V và phần trăm khối lượng các muối trong Z là:
A. V = 4,48 lít và %mNaCl = 69,44% ; %mNaBr = 30,56%.
B. V = 4,48 lít và %mNaCl = 30,56% ; %mNaBr = 69,44%.
C. V = 5,6 lít và %mNaCl = 69,44% ; %mNaBr = 30,56%.
D. V = 5,6 lít và %mNaCl = 50% ; %mNaBr = 50%.
-
Câu 19:
Đốt 13 gam bột một kim loại hóa trị II trong oxi dư đến khối lượng không đổi thu được chất rắn X có khối lượng 16,2 gam (giả sử hiệu suất phản ứng là 100%). Kim loại đó là
A. Fe.
B. Cu.
C. Zn.
D. Ca.
-
Câu 20:
Hấp thụ hoàn toàn 6,4 gam SO2 vào dung dịch NaOH 1M, sau phản ứng thu được 11,5 gam muối. Thể tích dung dịch NaOH cần là
A. 150 ml
B. 250 ml
C. 200 ml
D. 275 ml
-
Câu 21:
Nhúng thanh sắt dư vào 200 ml dung dịch chứa HCl 0,2M và mol H2SO4 0,1M đến khi phản ứng hoàn toàn thu được V lít khí. Giá trị của V là
A. 0,448.
B. 1,344.
C. 0,896.
D. 1,792.
-
Câu 22:
Để khử hoàn toàn 3,04 gam hỗn hợp X gồm FeO, Fe3O4, Fe2O3, cần 0,05 mol H2. Mặt khác hoà tan hoàn toàn 3,04 gam hỗn hợp X trong dung dịch H2SO4 đặc nóng thì thu được thể tích V ml SO2 (đktc). Giá trị V(ml) là:
A. 112ml
B. 224 ml
C. 336 ml
D. 448 ml
-
Câu 23:
Hoà tan hoàn toàn 4,0 gam hỗn hợp Mg, Fe, Cu bằng dung dịch H2SO4 đặc, nóng, dư thu được 2,24 lít khí SO2 duy nhất (đktc) và dung dịch chứa m gam muối. Giá trị của m là
A. 23,2.
B. 13,6.
C. 12,8.
D. 14,4.
-
Câu 24:
Dẫn V lít khí SO2 (đktc) vào 100 ml dung dịch Ba(OH)2 0,5 M thu được dung dịch A chỉ chứa một chất tan duy nhất và không có khí thoát ra. Thêm tiếp NaOH dư vào dung dịch A thu được m gam kết tủa. Tìm giá trị của V và m.
A. V = 2,24 lít và m = 21,7 gam.
B. V = 2,24 lít và m = 10,85 gam
C. V = 1,12 lít và m = 21,7 gam.
D. V = 1,12 lít và m = 10,85 gam.
-
Câu 25:
Công thức của Olenum là gì?
A. H2SO4.nSO2
B. H2SO4.nH2O
C. H2SO4.nSO3
D. H2SO4 đặc
-
Câu 26:
Tính oxi hóa của lưu huỳnh thể hiện qua phản ứng nào sau đây
A. Tác dụng với kim loại
B. Tác dụng với hidro
C. Tác dụng với phi kim
D. Cả A và B đều đúng
-
Câu 27:
Tính oxi hóa của lưu huỳnh thể hiện qua phản ứng nào sau đây
A. Tác dụng với kim loại
B. Tác dụng với hidro
C. Tác dụng với phi kim
D. Cả A và B đều đúng
-
Câu 28:
Phát biểu nào sau đây sai ?
A. khí oxi không màu, không mùi, nặng hơn không khí
B. khí ozon màu xanh nhạt, có mùi đặc trưng
C. ozon là một dạng thù hình của oxi, có tính oxi hóa mạnh hơn oxi
D. ozon và oxi đều được dùng để khử trùng nước sinh hoạt
-
Câu 29:
Chất nào có tính khử mạnh nhất ?
A. HI
B. HF
C. HBr
D. HCl
-
Câu 30:
Kim loại nào sau đây không tác dụng với dung dịch H2SO4 loãng?
A. Mg
B. Al
C. Fe
D. Cu
-
Câu 31:
Trong các phản ứng hóa học, axit HCl có thể đóng vai trò là
A. chất khử
B. chất oxi hóa.
C. chất trao đổi.
D. chất khử, chất oxi hóa hoặc trao đổi.
-
Câu 32:
Khi sục Cl2 vào nước thu được nước clo có màu vàng nhạt. Trong nước clo có chứa các chất
A. Cl2, H2O.
B. HCl, HClO.
C. HCl, HClO, H2O.
D. Cl2, HCl, HClO, H2O.
-
Câu 33:
Trong công nghiệp, từ khí SO2 và oxi, phản ứng hóa học tạo thành SO3 xảy ra ở điều kiện nào sau đây?
A. Nhiệt độ phòng.
B. Đun nóng đến 500oC.
C. Đun nóng đến 500oC và có mặt xúc tác V2O5.
D. Nhiệt độ phòng và có mặt chất xúc tác V2O5.
-
Câu 34:
Cho 21,8 gam hỗn hợp X gồm Al, Fe và Zn đốt trong khí clo dư thu được 57,3 gam hỗn hợp muối Y. Cho Y vào dung dịch AgNO3 dư thu được kết tủa có khối lượng là
A. 114,8 gam.
B. 129,15 gam.
C. 143,5 gam.
D. 157,85 gam.
-
Câu 35:
Nước Gia-ven và clorua vôi thường được dùng để
A. sản xuất clo trong công nghiệp.
B. tẩy trắng sợi, vải, giấy và tẩy uế.
C. sản xuất HCl trong phòng thí nghiệm.
D. sản xuất phân bón hóa học.
-
Câu 36:
Cho phương trình phản ứng:
SO2 + KMnO4 + H2O → K2SO4 + MnSO4 + H2SO4
Sau khi cân bằng với hệ số là các giá trị tối giản, hệ số của chất oxi hoá và chất khử là
A. 5 và 2.
B. 2 và 5.
C. 2 và 2.
D. 5 và 5.
-
Câu 37:
Đun nóng một hỗn hợp gồm 6,4 gam bột lưu huỳnh và 15 gam bột kẽm trong môi trường kín không có không khí. Chất nào còn dư sau phản ứng và có khối lượng là bao nhiêu?
A. Zn; 2g
B. Zn; 8,45g
C. S; 2g
D. S; 3,2g
-
Câu 38:
Hỗn hợp O2 và O3 có tỉ khối đồi với H2 bằng 20. Phần trăm số mol O2 và O3 lần lượt là (cho biết H = 1; O = 16)
A. 40 và 60
B. 75 và 25
C. 60 và 40
D. 50 và 50
-
Câu 39:
Hấp thụ 2,24 lít Cl2 (đktc) vào 250 ml dung dịch NaOH 1M, sau phản ứng thu được dung dịch A. Cô cạn dung dịch A thu được m gam rắn khan. Giá trị của m là:
A. 13,3 gam.
B. 15,3 gam.
C. 5,85 gam.
D. 7,45 gam.
-
Câu 40:
Cho 1,03 gam muối natri halogenua A tác dụng với dung dịch AgNO3 dư thu được một kết tủa. Kết tủa này sau khi bị phân hủy hoàn toàn cho 1,08 gam Ag. Muối A là
A. NaF
B. NaCl
C. NaBr
D. NaI











