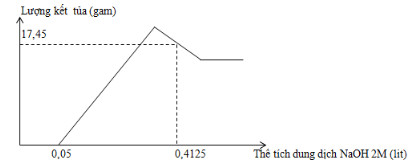
Hòa tan hoàn toàn m gam hỗn hợp gồm Al và Mg trong V ml dung dịch HNO3 2,5M. Kết thúc phản ứng thu được dung dịch X (không chứa muối amoni) và 0,084 mol hỗn hợp khí N2 và N2O có tỉ khối so với oxi là 31:24. Cho từ từ dung dịch NaOH 2M vào dung dịch X thì lượng kết tủa biến thiên theo đồ thị hình vẽ bên.
Giá trị của m và V lần lượt là
Suy nghĩ trả lời câu hỏi trước khi xem đáp án
Lời giải:
Báo sai- Xét hỗn hợp khí: Mkhí = 32.31/24 = 124/3
⟹ nN2 + nN2O = 0,084 mol và 28nN2 + 44nN2O = 0,084.124/3
⟹ nN2 = 0,014; nN2O = 0,07 mol
- Xét phản ứng kim loại và HNO3:
ne = 3nAl + 2nMg = 10nN2 + 8nN2O = 0,7 mol (*)
nHNO3 pứ = 12nN2 + 10nN2O = 0,868 mol
- Xét đồ thị :
+) Tại nNaOH = 0,05.2 = 0,1 mol thì bắt đầu có kết tủa ⟹ nHNO3 dư = nNaOH = 0,1 mol
⟹ ånHNO3 = 0,868 + 0,1 = 0,968 mol ⟹ VHNO3 = 0,968 : 2,5 = 0,3872 lit = 387,2 ml
+) Tại nNaOH = 0,4125.2 = 0,825 mol (Lúc này lượng kết tủa giảm sau khi đạt max)
⟹ Al(OH)3 tan 1 phần ⟹ nNaOH pứ = nNaOH - nHNO3 dư - 2nMg(OH)2
Các phản ứng: H+ + OH- → H2O
Mg2+ + 2OH- → Mg(OH)2
Al3+ + 3OH- → Al(OH)3
Al(OH)3 + OH- → AlO2- + 2H2O
⟹ mkết tủa = mMg(OH)2 + mAl(OH)3 = 58.nMg + 78.(4nAl - nOH-)
⟹ 17,45 = 58.nMg + 78.[4nAl - (0,825 - 0,1 - 2nMg)] (**)
Từ (*) và (**) ⟹ nMg = 0,2; nAl = 0,1 mol
⟹ m = mAl + mMg = 27.0,1 + 24.0,2 = 7,5 gam.
Đề thi thử THPT QG năm 2022 môn Hóa học
Trường THPT Yên Lạc 2











