Trắc nghiệm Bài tập về lưu huỳnh Hóa Học Lớp 10
-
Câu 1:
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Em hãy xác định xem tỉ lệ a:b bằng bao nhiêu?
-
Câu 2:
Cho 11 gam hỗn hợp bột sắt và bột nhôm phản ứng với bột lưu huỳnh trong điều kiện không có không khí thấy có 12,8 gam S tham gia phản ứng, hãy xác định mFe trong hỗn hợp ban đâu?
-
Câu 3:
Đun 20 gam X gồm Fe và S thu được A. Cho A vào HCl thu được 6,72 lít (đktc) hỗn hợp khí Y. Hãy tính thành phần phần trăm khối lượng Fe trong X là mấy?
-
Câu 4:
Một hóa chất phân biệt phân biệt khí oxi và ozon là gì?
-
Câu 5:
Giữa cặp chất không xảy ra phản ứng hóa học là cặp nào trong số 4 cặp sau?
-
Câu 6:
Hợp chất trong 4 chất sau không phản ứng với O2?
-
Câu 7:
Oxi hóa hoàn toàn m gam kim loại X cần vừa đủ 0,25m gam khí O2. Xác định kim loại tham gia phản ứng?
-
Câu 8:
Đốt cháy hoàn toàn 17,4 gam hỗn hợp Mg và Al cần mấy lít oxi (dư) để thu được 30,2 gam hỗn hợp oxit?
-
Câu 9:
Oxi hóa hoàn toàn 10,8 gam kim loại nào trong 4 kim loại sau trong khí O2 (dư) để thu được 20,4 gam oxit kim loại?
-
Câu 10:
Cần oxi hoá bao nhiêu gam hỗn hợp X gồm Cu và Al có tỉ lệ mol 1:1 để em sẽ thu được 13,1 gam hỗn hợp Y gồm các oxit.
-
Câu 11:
Cho Fe và FeS tác dụng với HCl (dư) được 2,464 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này qua Pb(NO3) 2 (dư), thu được 23,9 gam kết tủa đen. Hỗn hợp khí thu được gồm những khí nào?
-
Câu 12:
Đun hỗn hợp bột gồm 2,97 gam Al và 4,08 gam S được sản phẩm là A. Ngâm A trong HCl dư, thu được hỗn hợp khí B. Xác định khối lượng các chất trong hỗn hợp A.
-
Câu 13:
PUHH chứng tỏ SO2 là chất oxi hóa:
-
Câu 14:
Khi đốt cháy khí hidrosunfua trong điều kiện dư oxi thì sản phẩm cháy thu được gồm các chất nào sau đây ?
-
Câu 15:
Khi cho SO2 sục qua dung dịch X từ từ đến dư thấy xuất hiện kết tủa màu trắng sau đó kết tủa tan. X là dung dịch nào trong các dung dịch sau:
-
Câu 16:
Tại sao khi cho khí H2S lội qua dung dịch CuSO4 thấy có kết tủa màu xám đen xuất hiện?
-
Câu 17:
Lưu huỳnh đioxit có thể tham gia vào các phản ứng hóa học sau:
SO2 + Br2 + H2O → 2HBr + H2SO4 (1);
SO2 + 2H2S → 3S + 2H2O (2)
Câu nào sau đây diễn tả không đúng tính chất của các chất trong những phản ứng trên:
-
Câu 18:
Hidro sunfua có tính khử mạnh là do trong hợp chất H2S lưu huỳnh có số oxi hoá biểu hiện như thế nào?
-
Câu 19:
Điều nào sai khi nói về tính chất của SO2
-
Câu 20:
Oxit nào không có tính khử:
-
Câu 21:
Viết công thức phân tử của kali sunfua?
-
Câu 22:
Chất dùng để phân biệt CO2 và SO2 là gì?
-
Câu 23:
Cho Pb(NO3)2 vào muối nào sau đây để xuất hiện kết tủa đen?
-
Câu 24:
Tính CM của HCl khi đun nóng hỗn hợp X gồm 4,2 gam bột Fe và 1,2 gam bột S trong điều kiện không có oxi, sau khi phản ứng xảy ra hoàn toàn thu được chất rắn Y. Cho toàn bộ Y vào 200 ml dung dịch HCl vừa đủ thu được một hỗn hợp khí bay ra?
-
Câu 25:
Khi tác dụng với các phi kim hoạt động mạnh hơn, S thể hiện những số oxi hóa nào?
-
Câu 26:
Cho 2,8 gam Fe tác dụng hết với S, sau phản ứng thu được bao nhiêu gam muối?
-
Câu 27:
Viết cấu hình e ngoài cùng của S?
-
Câu 28:
Nung nóng hỗn hợp gồm 3 mol Fe và 2 mol S trong môi trường không có không khí đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn X. Cho X tác dụng với dung dịch HCl dư thu được khí Y. Thành phần của khí Y là
-
Câu 29:
Nung 28 gam Fe với 16 gam S ở nhiệt độ cao trong điều kiện không có không khí, thu được hỗn hợp chất rắn X. Cho X vào dung dịch HCl dư thu được hỗn hợp khí Y. Tỉ khối của Y đối với H2 là 10,6. Hiệu suất của phản ứng giữa Fe với S là
-
Câu 30:
Tính V thu được khi đốt cháy hoàn toàn 8 gam lưu huỳnh trong bình chứa khí oxi dư?
-
Câu 31:
Chất khử của S thể hiện ở phản ứng nào?
-
Câu 32:
Câu nào sau đây là sai khi nói về S?
-
Câu 33:
Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a : b bằng
-
Câu 34:
Anion X2- phân mức năng lượng cao nhất là 3p chứa 6 electron. Nguyên tố X là
-
Câu 35:
Lưu huỳnh tác dụng với dung dịch kiềm nóng theo phản ứng sau:
3S + 6KOH → 2K2S + K2SO3 + 3H2O
Trong phản ứng này có tỉ lệ số nguyên tử lưu huỳnh bị oxi hóa : số nguyên tử lưu huỳnh bị khử là:
-
Câu 36:
Viết cấu hình e của S (Z = 16)?
-
Câu 37:
Câu sai về lưu huỳnh?
-
Câu 38:
Đốt 4 mol lưu huỳnh phản ứng hoàn toàn với 2 mol oxi. Tính khối lượng SO2 tạo thành?
-
Câu 39:
Từ số oxi hóa của lưu huỳnh kết luận nào sau đây là đúng về tính chất hóa học cơ bản của S đơn chất:
-
Câu 40:
Nêu các số OXH của S?
-
Câu 41:
Tìm câu đúng về S?
-
Câu 42:
Các chất đều tác dụng với S (trong điều kiện phản ứng thích hợp) là:
-
Câu 43:
S có bao nhiêu dạng thù hình?
-
Câu 44:
Kim loại phản ứng với bột S?
-
Câu 45:
Ta dùng chất nào trong các chất sau để khử độc thủy ngân?
-
Câu 46:
Lưu huỳnh là một phi kim phổ biến, không mùi, không vị, nhiều hóa trị. Lưu huỳnh, trong dạng gốc của nó là chất rắn kết tinh màu vàng chanh. Trong tự nhiên, nó có thể tìm thấy ở dạng đơn chất hay trong các khoáng chất sulfua và sulfat. Nó là một nguyên tố thiết yếu cho sự sống và được tìm thấy trong hai axít amin. Sử dụng thương mại của nó chủ yếu trong các phân bón nhưng cũng được dùng rộng rãi trong thuốc súng, diêm, thuốc trừ sâu và thuốc diệt nấm. Trong phản ứng hóa học, 1 nguyên tử lưu huỳnh (S) chuyển thành ion sunfua (S2–) bằng cách:
-
Câu 47:
Các ion đơn nguyên tử: X+ và Y2- có cấu hình eletron là [Ar]. Nhận định nào sau đây là sai?
-
Câu 48:
Nêu cách để thu hồi thủy ngân rơi vãi?
-
Câu 49:
Cho phản ứng giữa lưu huỳnh với hidro như hình vẽ sau, trong đó ống nghiệm 1 để tạo ra H2 , ống nghiệm thứ 2 dùng để nhận biết sản phẩm trong ống. Hãy cho biết hiện tượng quan sát được trong ống nghiệm 2 là:
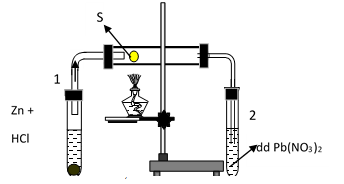
-
Câu 50:
Câu nào sau đây diễn tả đúng tính chất hóa học của lưu huỳnh?











