Đề thi HK1 môn Hóa học 10 CTST năm 2022-2023
Trường THPT Nguyễn Đình Chiểu
-
Câu 1:
Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron và neutron.
B. proton và neutron.
C. neutron và electron.
D. electron, proton và neutron.
-
Câu 2:
Thông tin nào sau đây không đúng?
A. Proton mang điện tích dương, nằm trong hạt nhân.
B. Nguyên tử trung hòa về điện.
C. Proton và electron có khối lượng gần bằng nhau.
D. Nguyên tử có cấu trúc rỗng.
-
Câu 3:
Một nguyên tử được đặc trưng cơ bản bằng
A. số proton và số đơn vị điện tích hạt nhân.
B. số proton và số electron.
C. số khối và số neutron.
D. số khối và số đơn vị điện tích hạt nhân.
-
Câu 4:
Số neutron (N) trong nguyên tử của một nguyên tố hoá học có thể tính được khi biết số khối (A), số hiệu nguyên tử (Z) theo công thức:
A. A = Z – N.
B. N = A – Z.
C. A = N – Z.
D. Z = N + A.
-
Câu 5:
Nguyên tử Z có 7 neutron và 6 proton. Kí hiệu nguyên tử của Z là
A. \(_6^7Z\)
B. \(_6^{13}Z\)
C. \(_7^{13}Z\)
D. \(_7^6Z\)
-
Câu 6:
Hình ảnh dưới đây là hình dạng của loại orbital nguyên tử nào?
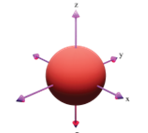
A. Orbital s
B. Orbital p
C. Orbital d
D. Orbital f
-
Câu 7:
Lớp M có bao nhiêu phân lớp?
A. 1
B. 2
C. 3
D. 4
-
Câu 8:
Cho nguyên tử X có 2 lớp eletron, lớp thứ 2 có 6 electron. Số hiệu nguyên tử X là
A. 8.
B. 6.
C. 12.
D. 16.
-
Câu 9:
Cho những nguyên tử của các nguyên tố sau:
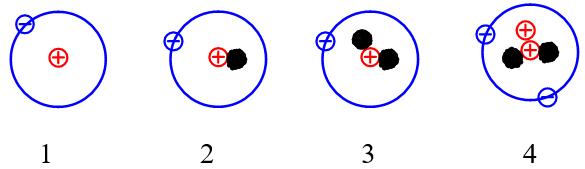
Những nguyên tử nào sau đây là đồng vị của nhau?
A. 1 và 2.
B. 2 và 3.
C. 1, 2 và 3.
D. 1, 2, 3 và 4.
-
Câu 10:
Electron thuộc lớp nào sau đây liên kết chặt chẽ nhất với hạt nhân?
A. Lớp N.
B. Lớp L.
C. Lớp M.
D. Lớp K.
-
Câu 11:
Nguyên tử nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của X là
A. [Ne] 3s23p2.
B. [Ne] 3s23d2.
C. [He] 3s23p2.
D. [Ar] 3s23p2.
-
Câu 12:
Ở trạng thái cơ bản, nguyên tử aluminium (Al) có số electron độc thân là
A. 1
B. 2
C. 3
D. 4
-
Câu 13:
Số hiệu nguyên tử của nguyên tố hóa học bằng
A. số thứ tự của ô nguyên tố.
B. số thứ tự của chu kì.
C. số thứ tự của nhóm.
D. số electron lớp ngoài cùng của nguyên tử.
-
Câu 14:
Chu kì 4 của bảng hệ thống tuần hoàn có
A. 2 nguyên tố.
B. 18 nguyên tố.
C. 32 nguyên tố.
D. 8 nguyên tố.
-
Câu 15:
Nhóm nguyên tố là
A. tập hợp các nguyên tố mà nguyên tử có cùng cấu hình electron giống nhau được xếp ở cùng một cột.
B. tập hợp các nguyên tố mà nguyên tử có cấu hình electron gần giống nhau, do đó có tính chất hóa học giống nhau và được xếp thành một cột.
C. tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp cùng một cột.
D. tập hợp các nguyên tố mà nguyên tử có tính chất hóa học giống nhau và được xếp cùng một cột.
-
Câu 16:
Nguyên tố nào sau đây thuộc nhóm A?
A. [Ne]3s23p3.
B. [Ar]3d14s2.
C. [Ar]3d74s2.
D. [Ar]3d54s2.
-
Câu 17:
Trong các nguyên tố nhóm A, đại lượng nào sau đây không biến đổi tuần hoàn?
A. Bán kính nguyên tử.
B. Tính kim loại.
C. Độ âm điện.
D. Khối lượng nguyên tử.
-
Câu 18:
Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, những yếu tố sẽ tăng dần là
A. bán kính nguyên tử và tính phi kim.
B. độ âm điện và tính phi kim.
C. bán kính nguyên tử và tính kim loại.
D. độ âm điện và tính kim loại.
-
Câu 19:
Dãy nào sau đây sắp xếp thứ tự tăng dần tính acid?
A. H3PO4 ; H2SO4 ; H3AsO4.
B. H2SO4 ; H3AsO4 ; H3PO4.
C. H3PO4; H3AsO4; H2SO4.
D. H3AsO4; H3PO4; H2SO4 .
-
Câu 20:
Nguyên tố X ở chu kì 2, nhóm IIA của bảng tuần hoàn. Cấu hình electron của nguyên tử nguyên tố X là
A. 1s22s22p2.
B. 1s22s2.
C. 1s22s3.
D. 1s22s22p63s2
-
Câu 21:
Trong các nhóm A, sự biến thiên tính chất của các nguyên tố thuộc chu kì sau lại lặp lại giống như chu kì trước (biến đổi tuần hoàn) là do
A. sự lặp lại tính kim loại của các nguyên tố ở chu kì sau so với chu kì trước.
B. sự lặp lại tính phi kim của các nguyên tố ở chu kì sau so với chu kì trước.
C. sự lặp lại cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố ở chu kì sau so với chu kì trước.
D. sự lặp lại tính chất hóa học của các nguyên tố ở chu kì sau so với chu kì trước.
-
Câu 22:
Trong một chu kì, theo chiều tăng của điện tích hạt nhân, độ âm điện thường
A. giảm xuống.
B. tăng dần.
C. biến đổi không theo quy luật.
D. không thay đổi.
-
Câu 23:
Cho các nguyên tố O (Z = 8), F (Z = 9), Si (Z = 14), S (Z = 16). Nguyên tố có tính phi kim lớn nhất trong số các nguyên tố trên là
A. O.
B. F.
C. S.
D. Si.
-
Câu 24:
X là nguyên tố nhóm IA. Công thức oxide ứng với hóa trị cao nhất của X là
A. XO.
B. XO2.
C. X2O.
D. X2O3.
-
Câu 25:
Nguyên tố X thuộc nhóm IA, còn nguyên tố Z thuộc nhóm VIIA của bảng tuần hoàn. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố X, Z lần lượt là
A. ns1 và ns2np5.
B. ns1 và ns2np7.
C. ns1 và ns2np3.
D. ns2 và ns2np5.
-
Câu 26:
Để lớp vỏ thỏa mãn quy tắc octet, nguyên tử oxygen (Z = 8) có xu hướng
A. nhường 6 electron
B. nhận 2 electron
C. nhường 8 electron
D. nhận 6 electron
-
Câu 27:
Khi nguyên tử nhận electron sẽ tạo thành
A. phân tử.
B. ion.
C. cation.
D. anion.
-
Câu 28:
Chất nào sau đây là hợp chất ion?
A. SO2.
B. CO2.
C. K2O.
D. HCl.
-
Câu 29:
X và Y thuộc cùng một nhóm và ở hai chu kì liên tiếp. Tổng số đơn vị điện tích hạt nhân của X và Y là 18 (biết Z< Z). Hai nguyên tố X; Y là
A. Be (Z = 4) và Si (Z = 14).
B. B (Z = 5) và Al (Z = 13).
C. N (Z = 7) và Na (Z = 11).
D. C (Z = 6) và Mg (Z = 12).
-
Câu 30:
Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt tới cấu hình electron bền vững theo quy tắc octet?
A. X (Z = 12).
B. Y (Z = 9).
C. Q (Z = 11).
D. T (Z = 10).
-
Câu 31:
Liên kết cộng hoá trị thường được hình thành giữa
A. các nguyên tử nguyên tố kim loại với nhau.
B. các nguyên tử nguyên tố phi kim với nhau.
C. các nguyên tử nguyên tố kim loại với các nguyên tố phi kim
D. các nguyên tử khí hiếm với nhau.
-
Câu 32:
Cho các hợp chất sau: Na2O; H2O; HCl; Cl2; O3; CH4. Có bao nhiêu chất mà trong phân tử chứa liên kết cộng hóa trị phân cực?
A. 2
B. 3
C. 5
D. 6
-
Câu 33:
Số lượng cặp electron dùng chung trong các phân tử O2, N2, F2 lần lượt là
A. 2, 3, 4
B. 2, 3, 1
C. 2, 2, 2
D. 2, 2, 1
-
Câu 34:
Cấu hình electron ở lớp ngoài cùng của nguyên tử nguyên tố X là 3s23p5. Liên kết của nguyên tử này với nguyên tử hydrogen thuộc loại liên kết nào sau đây?
A. Liên kết cộng hóa trị không cực.
B. Liên kết cộng hóa trị có cực.
C. Liên kết ion.
D. Liên kết kim loại.
-
Câu 35:
Liên kết trong phân tử nào sau đây được hình thành nhờ sự xen phủ orbital p-p ?
A. H2.
B. NH3.
C. HCl.
D. Cl2.
-
Câu 36:
Nhóm chất nào sau đây có liên kết “cho – nhận”?
A. KCl, CO2
B. HBr, MgCl2.
C. H2O, HCl.
D. NH4Cl, CO.
-
Câu 37:
Cho các phát biểu sau
(a) Liên kết hydrogen yếu hơn liên kết ion và liên kết cộng hóa trị.
(b) Liên kết hydrogen mạnh hơn liên kết ion và liên kết cộng hóa trị.
(c) Tương tác van der Waals yếu hơn liên kết hydrogen.
(d) Tương tác van der Waals mạnh hơn liên kết hydrogen.
Phát biểu đúng là
A. (a) và (c).
B. (a) và (d).
C. (b) và (c).
D. (b) và (d).
-
Câu 38:
Liên kết ion có bản chất là
A. sự dùng chung các electron.
B. lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
C. lực hút tĩnh điện giữa cation kim loại với các electron tự do.
D. lực hút giữa các phân tử.
-
Câu 39:
Cặp nguyên tố nào sau đây có khả năng tạo thành liên kết ion trong hợp chất của chúng?
A. Nitrogen và oxygen.
B. Carbon và oxygen.
C. Sulfur và oxygen.
D. Calcium và oxygen.
-
Câu 40:
Chất nào sau đây không thể tạo được liên kết hydrogen?
A. H2O.
B. CH4.
C. CH3OH.
D. NH3.











