Đề thi giữa HK1 môn Hóa học 10 KNTT năm 2022-2023
Trường THPT Lý Thái Tổ
-
Câu 1:
Nội dung thuộc đối tượng nghiên cứu của hóa học là
A. quỹ đạo chuyển động của Trái đất.
B. tốc độ ánh sáng trong chân không.
C. sự tiến hóa của loài người.
D. sự biến đổi của các chất.
-
Câu 2:
Nguyên tử gồm
A. hạt nhân chứa proton, neutron và vỏ nguyên tử chứa electron.
B. hạt nhân chứa proton, electron.
C. hạt nhân chứa proton, electron và vỏ nguyên tử chứa neutron.
D. hạt nhân và vỏ nguyên tử chứa proton.
-
Câu 3:
Cho các nguyên tử sau: A (Z = 8, A = 16), B (Z = 9, A = 19), C (Z = 8, A = 17), D (Z = 7, A = 17). Trong các nguyên tử trên, các nguyên tử thuộc cùng một nguyên tố hóa học là
A. nguyên tử A và nguyên tử B.
B. nguyên tử C và nguyên tử D.
C. nguyên tử A và nguyên tử C.
D. nguyên tử B và nguyên tử C.
-
Câu 4:
Một nguyên tử có chứa 11 electron và 12 neutron. Kí hiệu nguyên tử này là
A. \({}_{{\rm{23}}}^{{\rm{11}}}{\rm{Na}}\)
B. \({}_{12}^{23}{\rm{Na}}\)
C. \({}_{{\rm{23}}}^{{\rm{12}}}{\rm{Na}}\)
D. \({}_{11}^{23}{\rm{Na}}\)
-
Câu 5:
Một loại nguyên tử hydrogen có cấu tạo đơn giản nhất, chỉ tạo nên từ 1 electron và 1 proton (không chứa neutron). Phát biểu nào sau đây là đúng khi nói về nguyên tử hydrogen này?
A. Đây là nguyên tử nặng nhất trong số các nguyên tử được biết cho đến nay.
B. Khối lượng nguyên tử xấp xỉ 2 amu.
C. Hạt nhân nguyên tử có khối lượng gấp khoảng 1818 lần khối lượng lớp vỏ.
D. Kích thước của nguyên tử bằng kích thước của hạt nhân.
-
Câu 6:
Hạt nhân nguyên tử X có chứa 15 proton và 16 neutron. Số khối của hạt nhân nguyên tử X là
A. 30.
B. 31.
C. 32
D. 46.
-
Câu 7:
Nguyên tử nitrogen có 7 electron. Điện tích hạt nhân của nguyên tử này là
A. +7.
B. -7.
C. 7+.
D. 7
-
Câu 8:
Trong tự nhiên, lithium có 2 đồng vị là 7Li và 6Li. Nguyên tử khối trung bình của Li là 6,93. Phần trăm số nguyên tử của đồng vị 7Li là
A. 93%.
B. 7%.
C. 78%.
D. 22%.
-
Câu 9:
Sự phân bố electron vào các lớp và phân lớp căn cứ vào
A. số khối.
B. điện tích hạt nhân.
C. nguyên tử khối.
D. mức năng lượng electron.
-
Câu 10:
Lớp electron thứ 4 còn được gọi là
A. Lớp K.
B. Lớp M.
C. Lớp N.
D. Lớp L.
-
Câu 11:
Ở trạng thái cơ bản, nguyên tử của nguyên tố phosphorus (Z = 15) có số electron độc thân là
A. 1
B. 2
C. 3
D. 4
-
Câu 12:
Số hiệu nguyên tử của nguyên tố hoá học bằng
A. số thứ tự của nhóm.
B. số thứ tự của chu kì.
C. số thứ tự của ô nguyên tố.
D. số electron lớp ngoài cùng của nguyên tử.
-
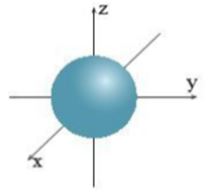
Câu 13:
Hình ảnh dưới đây chỉ hình dạng của orbital nào?
A. Orbital s.
B. Orbital p.
C. Orbital d.
D. Orbital f.
-
Câu 14:
Lớp M chứa số electron tối đa là
A. 3
B. 6
C. 9
D. 18
-
Câu 15:
Cấu hình electron của nguyên tử sulfur (Z = 16) là
A. 1s22s22p63s23p3.
B. 1s22s22p63s23p5.
C. 1s22s22p63s23p4.
D. 1s22s22p63s23p6.
-
Câu 16:
Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử X là 3s2. Số hiệu nguyên tử của nguyên tố X là
A. 12
B. 13
C. 11
D. 14
-
Câu 17:
Cấu hình electron của nguyên tử oxygen là 1s22s22p4. Vị trí của oxygen trong bảng tuần hoàn là
A. ô số 6, chu kì 2, nhóm VIA.
B. ô số 6, chu kì 3, nhóm VIB.
C. ô số 8, chu kì 2, nhóm VIB.
D. ô số 8, chu kì 2, nhóm VIA.
-
Câu 18:
Nguyên tố aluminium (Al) có số hiệu nguyên tử là 13. Al thuộc khối nguyên tố
A. s
B. p
C. d
D. f
-
Câu 19:
Nguyên tử của nguyên tố nào sau đây có tính phi kim mạnh nhất?
A. Fluorine.
B. Bromine.
C. Phosphorus.
D. Iodine.
-
Câu 20:
Phát biểu nào sau đây là đúng về xu hướng biến đổi tính kim loại trong bảng tuần hoàn các nguyên tố hóa học?
A. Tính kim loại của các nguyên tố tăng theo chiều từ trái sang phải trong một chu kì và từ trên xuống dưới trong một nhóm.
B. Tính kim loại giảm dần theo chiều từ trái sang phải trong một chu kì và tăng dần từ trên xuống dưới trong một nhóm.
C. Tính kim loại giảm dần theo chiều từ trái sang phải trong một chu kì và từ trên xuống dưới trong một nhóm.
D. Tính kim loại tăng dần theo chiều từ trái sang phải trong một chu kì và giảm dần từ trên xuống dưới trong một nhóm.
-
Câu 21:
Phát biểu nào sau đây là sai?
A. Tính kim loại là tính chất của một nguyên tố mà nguyên tử dễ nhường electron.
B. Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
C. Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân tính kim loại của các nguyên tố giảm dần, tính phi kim tăng dần.
D. Tính phi kim là tính chất của một nguyên tố mà nguyên tử dễ nhận electron
-
Câu 22:
X là nguyên tố nhóm IIA. Công thức oxide ứng với hóa trị cao nhất của X là
A. XO.
B. XO2.
C. X2O.
D. X2O2.
-
Câu 23:
Nguyên tử X có 15 electron ở lớp vỏ. Trong bảng tuần hoàn, nguyên tố X thuộc chu kì nào?
A. 4
B. 2
C. 5
D. 3
-
Câu 24:
Nguyên tố Ca có số hiệu nguyên tử là 20. Phát biểu nào sau đây về Ca là không đúng?
A. Số electron ở vỏ nguyên tử của nguyên tố Ca là 20.
B. Vỏ của nguyên tử Ca có 4 lớp electron và lớp ngoài cùng có 2 electron.
C. Hạt nhân của nguyên tử Ca có 20 proton
D. Nguyên tố Ca là một nguyên tố phi kim.
-
Câu 25:
Trong các hydroxide dưới đây. Hydroxide lưỡng tính là
A. Al(OH)3.
B. Mg(OH)2.
C. NaOH.
D. LiOH.
-
Câu 26:
Nguyên tố X thuộc chu kì 3 nhóm VIIA. Công thức hóa học của hydroxide (ứng với hóa trị cao nhất) của X là
A. H2XO3.
B. HX.
C. H2XO4.
D. HXO4.
-
Câu 27:
Yếu tố nào của nguyên tố hóa học cho dưới đây không biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử?
A. Tính kim loại.
B. Tính acid – base của các hydroxide.
C. Khối lượng nguyên tử.
D. Tính phi kim.
-
Câu 28:
Đại lượng đặc trưng cho khả năng hút electron của một nguyên tử khi tạo thành liên kết hóa học là
A. bán kính nguyên tử.
B. độ âm điện.
C. năng lượng ion hóa.
D. điện tích hạt nhân.
-
Câu 29:
Độ âm điện là
A. đại lượng đặc trưng cho khả năng nhường electron của nguyên tử một nguyên tố khi tạo thành liên kết hóa học.
B. đại lượng đặc trưng cho khả năng tạo thành phân tử.
C. đại lượng đặc trưng cho khả năng tạo thành nguyên tử.
D. đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố khi tạo thành liên kết hóa học.
-
Câu 30:
Sulfur là nguyên tố hóa học thuộc nhóm VIA của bảng tuần hoàn. Công thức oxide cao nhất của sulfur là
A. S2O6.
B. SO3.
C. SO6.
D. SO2.
-
Câu 31:
Oxide nào sau đây có tính base mạnh nhất?
A. MgO.
B. Cl2O7.
C. SO3.
D. Na2O.
-
Câu 32:
Trong các chất dưới đây, chất nào có tính acid yếu nhất?
A. H3PO4.
B. H2SiO3.
C. H2SO4.
D. HClO4.
-
Câu 33:
Các nguyên tố kim loại thuộc nhóm IA còn được gọi là
A. nhóm kim loại kiềm.
B. nhóm kim loại kiềm thổ.
C. nhóm halogen.
D. nhóm nguyên tố khí hiếm.
-
Câu 34:
Nguyên tố M thuộc chu kì 3, nhóm VA của bảng tuần hoàn. Số hiệu nguyên tử của nguyên tố M là
A. 16
B. 14
C. 15
D. 13
-
Câu 35:
Cấu hình eletron lớp ngoài cùng của nguyên tố X là 3s1. Oxide cao nhất của X có tính chất nào sau đây?
A. Tính kim loại.
B. Tính phi kim.
C. Tính acid.
D. Tính base.
-
Câu 36:
Sắp xếp tính base của NaOH, Mg(OH)2, Al(OH)3 theo chiều giảm dần là
A. NaOH, Mg(OH)2, Al(OH)3.
B. Al(OH)3, Mg(OH)2, NaOH.
C. Mg(OH)2, Al(OH)3, NaOH.
D. Mg(OH)2, NaOH, Al(OH)3.
-
Câu 37:
Nguyên tử của nguyên tố potassium có 19 electron. Ở trạng thái cơ bản, potassium có số electron độc thân là
A. 1
B. 2
C. 0
D. 3
-
Câu 38:
Trong tự nhiên, argon có các đồng vị 40Ar, 38Ar, 36Ar chiếm tương ứng khoảng 99,604%, 0,063% và 0,333% số nguyên tử. Nguyên tử khối trung bình của Ar gần nhất với đáp án là
A. 36,99.
B. 38,99.
C. 39,66.
D. 39,99.
-
Câu 39:
Mỗi orbital nguyên tử chứa tối đa bao nhiêu electron?
A. 1 electron.
B. 2 electron.
C. 3 electron.
D. 4 electron.
-
Câu 40:
Xét ba nguyên tử nguyên tố có cấu hình electron lần lượt là
X: 1s22s22p63s1
Q: 1s22s22p63s2
Z: 1s22s22p63s23p1
Tính base tăng dần của các hydroxide là
A. XOH < Q(OH)2 < Z (OH)3.
B. Z(OH)3 < XOH < Q (OH)2.
C. Z(OH)3 < Q(OH)2 < XOH.
D. XOH < Z(OH)2 < Q(OH)2.