850 câu trắc nghiệm môn Hóa học đại cương
Nhằm giúp các bạn ôn tập và hệ thống lại kiến thức nhanh chóng để đạt kết quả cao trong kì thi sắp tới, tracnghiem.net tổng hợp và chia sẻ đến các bạn 850 câu trắc nghiệm môn Hóa học đại cương, bao gồm các kiến thức tổng quan về các định luật và khái niệm cơ bản về hóa học, cấu tạo nguyên tử, bảng hệ thống tuần hoàn, liên kết hóa học, hiệu ứng nhiệt của các quá trình hóa học,cân bằng hóa học và mức độ diễn ra các quá trình hóa học,... Hi vọng sẽ trở thành nguồn tài liệu bổ ích giúp các bạn học tập và nghiên cứu một cách tốt nhất. Để ôn tập hiệu quả các bạn có thể ôn theo từng phần trong bộ câu hỏi này bằng cách trả lời các câu hỏi và xem lại đáp án và lời giải chi tiết. Sau đó các bạn hãy chọn mục "Thi thử" để hệ thống lại kiến thức đã ôn. Chúc các bạn thành công với bộ đề "Cực Hot" này nhé!
Chọn hình thức trắc nghiệm (45 câu/50 phút)
Chọn phần
-
Câu 1:
Chọn phát biểu đúng trong những phát biểu sau đây: (1) Việc thay đổi áp suất ngoài không làm thay đổi trạng thái cân bằng của phản ứng có tổng số mol chất khí của các sản phẩm bằng tổng số mol chất khí của các chất đầu. (2) Khi tăng nhiệt độ, cân bằng của một phản ứng bất kỳ sẽ dịch chuyển theo chiều thu nhiệt. (3) Khi giảm áp suất, cân bằng của một phản ứng bất kỳ sẽ dịch chuyển theo chiều tăng số phân tử khí. (4) Hệ đã đạt trạng thái cân bằng thì lượng các chất thêm vào không làm ảnh hưởng đến trạng thái cân bằng.
A. 1
B. 2 và 3
C. 1, 2 và 3
D. 1, 3 và 4
-
Câu 2:
Phản ứng: 2NO2 (k) ⇌ N2O4 (k) có \(\Delta G_{298}^0\) = - 4,835 kJ. Tính hằng số cân bằng KC của phản ứng ở 298K. Cho R = 8,314 J/mol.K.
A. KC = 172,03
B. KC = 7,04
C. KC = 17442,11
D. KC = 4168,57
-
Câu 3:
Cho phản ứng: CuBr2(r) ⇌ CuBr(r) + ½ Br2(k). Ở trạng thái cân bằng, T = 550K, PBr2 = 0.671 atm. Người ta cho 0,2 mol CuBr2(r) vào một bình chân không ở 550K. Hỏi thể tích bình phải bằng bao nhiêu để toàn bộ CuBr2 phân hủy hết theo phản ứng trên. Cho R = 0,082 lít.atm/mol.K.
A. 3,35 lít
B. 13,4 lít
C. 6,7 lít
D. 8,3 lít
-
Câu 4:
Cho phản ứng thuận nghịch: H2 (k) + I2 (k) ⇌ 2HI (k) hiệu suất của phản ứng là bao nhiêu nếu biết hằng số cân bằng KP của phản ứng ở nhiệt độ này là 54,5.
A. Không đủ dữ kiện để tính
B. 78,7%
C. 65,3%
D. 100%
-
Câu 5:
Cho K1 và K2 lần lượt là hằng số cân bằng của hai phản ứng sau: (1) XeF6 (k) + H2O (k) ⇌ XeOF4 (k) + 2HF (k) (2) XeO4 (k) + XeF6 (k) ⇌ XeOF4 (k) + XeO3F2 (k) Hãy xác định hằng số cân bằng K3 của phản ứng: (3) XeO4 (k) + 2 HF (k) ⇌ XeO3F2 (k) + H2O (k).
A. K3 = K1. K2
B. K3 = K1 + K2
C. K3 = K2 – K1
D. \({K_3} = \frac{{{K_2}}}{{{K_1}}}\)
-
Câu 6:
Chọn phát biểu đúng: Phản ứng A(k) ⇌ B(k) + C(k) ở 300oC có Kp = 11,5 và ở 500oC có Kp = 33. Vậy phản ứng trên là một quá trình:
A. thu nhiệt
B. đoạn nhiệt
C. đẳng nhiệt
D. tỏa nhiệt
-
Câu 7:
Một phản ứng tự xảy ra có DG0 < 0. Giả thiết rằng biến thiên entanpi và biến thiên entropi không phụ thuộc nhiệt độ, khi tăng nhiệt độ thì hằng số cân bằng Kp sẽ:
A. tăng
B. giảm
C. không đổi
D. chưa thể kết luận được
-
Câu 8:
Cân bằng trong phản ứng H2 (k) + Cl2 (k) ⇌ 2HCl (k) sẽ dịch chuyển theo chiều nào nếu tăng áp suất của hệ phản ứng?
A. Thuận
B. Nghịch
C. Không dịch chuyển
D. Không thể dự đoán
-
Câu 9:
Chọn ý đúng: (1) Một hệ đang ở trạng thái cân bằng, nếu ta thay đổi một yếu tố (áp suất, nhiệt độ, nồng độ) thì cân bằng sẽ chuyển dịch theo chiều chống lại sự thay đổi đó. (2) Khi tăng nhiệt độ, cân bằng sẽ chuyển dịch theo chiều phản ứng tỏa nhiệt; khi giảm nhiệt độ, cân bằng sẽ chuyển dịch theo chiều phản ứng thu nhiệt. (3) Hằng số cân bằng của một phản ứng là một đại lượng không đổi ở nhiệt độ xác định. (4) Khi thêm một chất (tác chất hay sản phẩm) vào hệ cân bằng, cân bằng sẽ dịch chuyển theo chiều làm giảm lượng chất đó.
A. 1 và 3
B. 1 và 4
C. 1 và 2
D. 1, 3 và 4
-
Câu 10:
Cho cân bằng CO2 (k) + H2 (k) ⇌ CO (k) + H2O (k). Tính hằng số cân bằng Kc biết rằng khi đến cân bằng ta có 0,4 mol CO2; 0,4 mol H2; 0,8 mol CO và 0,8 mol H2O trong một bình có dung tích là 1 lít. Nếu nén hệ cho thể tích của hệ giảm xuống, cân bằng sẽ chuyển dịch như thế nào?
A. Kc = 8 ; theo chiều thuận
B. Kc = 4 ; không đổi
C. Kc = 4 ; theo chiều thuận
D. Kc = 8 ; theo chiều nghịch
-
Câu 11:
Xét phản ứng: CH3COOH + C2H5OH ⇌ CH3COOC2H5 + H2O; Kc = 4. Suy ra hằng số cân bằng của phản ứng thủy phân CH3COOC2H5 là:
A. K’C = ¼
B. K’C = ½
C. K’C = 4
D. K’C = -4
-
Câu 12:
Chọn giải pháp hợp lí nhất: Cho phản ứng: N2 (k) + O2 (k) ⇌ 2NO (k); DH > 0. Để thu được nhiều NO ta có thể dùng các biện pháp:
A. Tăng áp suất và giảm nhiệt độ
B. Giảm nhiệt độ
C. Tăng nhiệt độ
D. Giảm áp suất
-
Câu 13:
Cho phản ứng: 2SO2(k) + O2(k) ⇌ 2SO3(k) ; DH < 0. Để được nhiều SO3 hơn, ta nên chọn biện pháp nào trong 3 biện pháp sau: (1) Giảm nhiệt độ. (2) Tăng áp suất. (3) Thêm O2.
A. Chỉ có biện pháp 1
B. Chỉ có 2
C. Chỉ có 2 và 3
D. Cả 3 biện pháp
-
Câu 14:
Chọn ý đúng: Tác động nào sẽ làm tăng hiệu suất phản ứng: CaCO3(r) ⇌ CaO (r) + CO2(k) ; DH > 0.
A. Tăng thể tích
B. Tăng nhiệt độ
C. Tăng áp suất
D. Tăng nồng độ CO2
-
Câu 15:
Phản ứng N2(k) + O2(k) ⇌ 2NO(k) , DH > 0 đang nằm ở trạng thái cân bằng. Hiệu suất phản ứng sẽ tăng lên khi áp dụng các biện pháp sau: (1) Dùng xúc tác. (2) Nén hệ. (3) Tăng nhiệt độ. (4) Giảm áp suất hệ phản ứng.
A. 3
B. 1 và 2
C. 1 và 3
D. 1, 3 và 4
-
Câu 16:
Chọn câu đúng: Xét hệ cân bằng: CO (k) + Cl2 (k) ⇌ COCl2 (k) , DH < 0. Sự thay đổi nào dưới đây dẫn đến cân bằng chuyển dịch theo chiều thuận:
A. Tăng nhiệt độ
B. Giảm thể tích bình phản ứng bằng cách nén hệ
C. Giảm áp suất
D. Tăng nồng độ COCl2
-
Câu 17:
Phản ứng thủy phân của ester: ester + nước ⇌ acid + rượu. Để tăng hiệu suất phản ứng (cân bằng chuyển dịch theo chiều thuận) ta có thể dùng các biện pháp nào trong 3 biện pháp sau: (1) dùng nhiều nước hơn. (2) bằng cách tiến hành thủy phân trong môi trường base. (3) Loại bỏ rượu.
A. Chỉ dùng được biện pháp 1
B. Chỉ dùng được biện pháp 2
C. Chỉ dùng được biện pháp 3
D. Dùng được cả ba biện pháp
-
Câu 18:
Cho các phản ứng:
(1) N2 (k) + O2 (k) ⇌ 2NO (k) DH° > 0
(2) N2 (k) + 3H2 (k) ⇌ 2NH3 (k) DH° < 0
(3) MgCO3 (r) ⇌ MgO (r) + CO2 (k) DH° > 0
Với phản ứng nào ta nên dùng nhiệt độ cao và áp suất thấp để cân bằng chuyển dịch theo chiều thuận.
A. Phản ứng (1)
B. Phản ứng (3)
C. Phản ứng (2)
D. Phản ứng (1) và (2)
-
Câu 19:
Các phản ứng dưới đây đang ở trạng thái cân bằng ở 25°C.
(1) N2 (k) + O2 (k) ⇌ 2 NO (k) DH° > 0.
(2) N2 (k) + 3H2 (k) ⇌ 2 NH3 (k) DH° < 0.
(3) MgCO3 (r) ⇌ CO2 (k) + MgO (r) DH° > 0.
(4) I2 (k) + H2(k) ⇌ 2HI (k) DH° < 0
Cân bằng của phản ứng nào dịch chuyển mạnh nhất theo chiều thuận khi đồng thời hạ nhiệt độ và tăng áp suất chung của:
A. Phản ứng 1
B. Phản ứng 3
C. Phản ứng 2
D. Phản ứng 4
-
Câu 20:
Chọn trường hợp đúng: Xét cân bằng:
2NO2 (k) (nâu) ⇌ N2O4 (k) (không màu) ; DH°298 = -14kcal
Trong bốn trường hợp dưới, màu nâu của NO2 sẽ đậm nhất khi:
A. Làm lạnh đến 273K
B. Đun nóng đến 373K
C. Tăng áp suất
D. Giữ ở 298K
-
Câu 21:
Phản ứng tỏa nhiệt dưới đây đã đạt trạng thái cân bằng: 2 A(k) + B(k) ⇌ 4D (k)
Để dịch chuyển cân bằng của phản ứng theo chiều hướng tạo thêm sản phẩm, một số biện pháp sau đây đã được sử dụng: (1) Tăng nhiệt độ ; (2) Thêm chất D ; (3) Giảm thể tích bình phản ứng ; (4) Giảm nhiệt độ ; (5) Thêm chất A ; (6) Tăng thể tích bình phản ứng.
A. 4, 5, 6
B. 1, 3, 5
C. 2, 3
D. 3
-
Câu 22:
Chọn phát biểu đúng: Cho phản ứng: SnO2(r) + 2H2(k) ⇌ 2H2O(k) + Sn(ℓ)
1) \(\Delta {G_T} = \Delta G_T^0 + RT\ln \frac{{{{\left[ {{H_2}O} \right]}^2}}}{{{{\left[ {{H_2}} \right]}^2}}}\)
2) \(\Delta G_T^0 = - RT\ln {K_c}\) , với \({K_c} = {\left( {\frac{{{{\left[ {{H_2}O} \right]}^2}}}{{{{\left[ {{H_2}} \right]}^2}}}} \right)_{cb}}\)
3) Phản ứng có KP = KC vì Dn = 0
A. 3
B. 1, 2
C. 2, 3
D. 1, 2, 3
-
Câu 23:
Quá trình khử thiếc IV bằng hydro: SnO2(r) + 2H2(k) ⇌ Sn(ℓ) + 2H2O(k) ở 1100K có hằng số cân bằng Kp = 10. Ở cùng nhiệt độ trên khi hỗn hợp khí có 24% hydro theo thể tích:
A. DG1100 » 0, hệ đạt trạng thái cân bằng.
B. DG1100 > 0, phản ứng đang diễn ra theo chiều nghịch.
C. Không đủ dữ liệu để kết luận về chiều hướng diễn ra của quá trình ở 1100K.
D. DG1100 < 0, phản ứng đang diễn ra theo chiều thuận.
-
Câu 24:
Chọn câu sai. Chất xúc tác:
A. Không làm thay đổi các đặc trưng nhiệt động của phản ứng.
B. Làm thay đổi hằng số cân bằng của phản ứng.
C. Chỉ có tác dụng xúc tác với một phản ứng nhất định.
D. Làm giảm năng lượng hoạt hóa của phản ứng.
-
Câu 25:
Cho phản ứng thuận nghịch sau: Co(H2O)62+ + 4Cl- ⇌ CoCl42- + 6H2O. Biết rằng Co(H2O)62+ có màu hồng, CoCl42- có màu xanh. Khi làm lạnh thì màu hồng đậm dần. Chọn phát biểu đúng: (1) Phản ứng theo chiều thuận là thu nhiệt. (2) Khi thêm một ít NaCl rắn thì màu hồng đậm dần. (3) Khi đun nóng màu xanh sẽ đậm dần.
A. 1, 2
B. Tất cả đều sai
C. 2, 3
D. 1, 3
-
Câu 26:
Khi hòa tan trong hexan, acid stearic xảy ra phản ứng chuyển hóa như sau: 2C17H35COOH (dd) ⇌ (C17H35COOH)2 (dd). Tại 28oC phản ứng có Kc = 2900 và tại 48oC có Kc = 40. Tính ∆Ho và ∆So của phản ứng.
A. ∆Ho = -2,39 kJ và ∆So = -537,32 J
B. ∆Ho = -172,05 kJ và ∆So = -505,32 J
C. ∆Ho = -86,32 kJ và ∆So = -249,14 J
D. ∆Ho = -55,07 kJ và ∆So = -80,31 J
-
Câu 27:
Phản ứng tổng hợp amoniac: 3 H2(k) + N2(k) ⇌ 2 NH3(k) có hằng số cân bằng là Kp = 5,9 ×105 tại 298 K, và hiệu ứng nhiệt của phản ứng là ∆Ho = - 92,2 kJ. Tính hằng số cân bằng Kp của phản ứng tại 600K. Biết rằng ∆Ho và ∆So của phản ứng thay đổi không đáng kể trong khoảng nhiệt độ 298 ÷ 600 K.
A. 4,3 × 10-3
B. 8,2 × 106
C. 5,6 × 105
D. 3,7 × 10-2
-
Câu 28:
Cho phản ứng: 2CO(k) + O2(k) ⇌ 2CO2(k). Chọn phát biểu đúng: Để thực hiện phản ứng thuận nghịch: (1) Người ta phải nạp vào bình phản ứng đúng 2 mol CO cho mỗi mol O2. (2) Bất kể lượng nạp vào ban đầu của hai chất, chỉ có 1 mol O2 sẽ phản ứng, và nó sẽ phản ứng với 2 mol CO. (3) Bất kể lượng nạp vào ban đầu của hai chất, khi chúng phản ứng, CO sẽ phản ứng với O2 theo tỉ lệ mol 2:1. (4) Khi nạp vào bình 2 mol CO và 1 mol O2 chúng sẽ phản ứng sinh ra 2 mol CO2.
A. Chỉ (3) đúng
B. Chỉ (2), (3) đúng
C. Chỉ (4) đúng
D. Chỉ (1), (4) đúng
-
Câu 29:
Ở một nhiệt độ xác định, cân bằng sau đây: N2(k) + 2O2(k) ⇌ 2NO2(k) có hằng số cân bằng K = 100. Tính hằng số cân bằng K’ của cân bằng: NO2(k) ⇌ ½ N2(k) + O2(k).
A. K’ = 0,01
B. K’ = 0,0001
C. K’ = 0,1
D. K’ = 1,0
-
Câu 30:
Trong một bình kín dung tích 1 lít người ta nạp vào 1,0 mol khí A, 1,4 mol khí B và 0,5 mol khí C. Sau khi cân bằng Ak + Bk ⇌ 2Ck được thiết lập, nồng độ cuối cùng của C là 0,75 mol/l. Tính hằng số cân bằng.
A. K = 12,5
B. K = 1,25
C. K = 0,15
D. K = 0,5
-
Câu 31:
Ở 46°C, cân bằng N2O4(k) ⇌ 2NO2(k) có hằng số cân bằng Kp = 0,66. Tính % phân ly của N2O4 ở 46°C và áp suất tổng bằng 0,5 atm.
A. 80%
B. 50%
C. 75%
D. 66,67%
-
Câu 32:
Trong các phản ứng sau, trường hợp nào là hệ dị thể:
1) C6H5ONa(dd) + HCl(dd) = C6H5OH(ℓ) + NaCl(dd)
2) 2NaOH(dd) + H2SO4(dd) = Na2SO4(dd) + 2H2O(ℓ)
3) CH3COOCH3(dd) + H2O(ℓ) = CH3COOH(dd) + CH3OH(dd)
4) 2Al(r) + Fe2O3(r) = Al2O3(r) + 3Fe(r)
5) C (kim cương) = C (graphit)
A. 1, 2, 3
B. 2, 3, 5
C. 1, 4, 5
D. 1, 2, 3, 4, 5
-
Câu 33:
Dung dịch của NaCl trong nước nằm cân bằng với NaCl rắn ở áp suất không đổi (P = const). Số cấu tử và bậc tự do của hệ lần lượt là:
A. 2 và 1
B. 2 và 0
C. 3 và 2
D. 2 và 2
-
Câu 34:
Nước nguyên chất có thể tồn tại ở 9 pha khác nhau là: khí, lỏng và 7 dạng thù hình của nước đá (rắn). Tính số pha tối đa của nước có thể đồng thời nằm cân bằng với nhau.
A. 2
B. 4
C. 5
D. 3
-
Câu 35:
Trong giản đồ trạng thái của một hợp chất được biểu diễn theo nhiệt độ và áp suất có xuất hiện điểm ba. Bậc tự do của hệ tại vị trí điểm ba này bằng:
A. 0
B. 1
C. 2
D. Không thể xác định
-
Câu 36:
Tính bậc tự do của hệ sau khi đang ở trạng thái cân bằng ở điều kiện áp suất không đổi: CaO(r) + SiO2(r) ⇌ CaSiO3(r)
A. 1
B. 0
C. 2
D. 3
-
Câu 37:
Chọn phương án đúng: Xét cân bằng: H2O(lỏng) ⇌ H2O(hơi). Số bậc tự do của hệ hơi nước cân bằng với nước lỏng là:
A. 1
B. 2
C. 3
D. 0
-
Câu 38:
Số cấu tử của hệ phản ứng: BaSO4(r) = BaO(r) + SO2(k) + O2(k) là:
A. 1
B. 2
C. 3
D. 4
-
Câu 39:
Số bậc tự do của hệ phản ứng: Ca(OH)2(r) = CaO(r) + H2O(k) là:
A. 2
B. 3
C. 4
D. 1
-
Câu 40:
Chọn phát biểu đúng về tính chất của điểm ơtecti (điểm E) trong giản đồ nóng chảy hệ hai kim loại A – B.
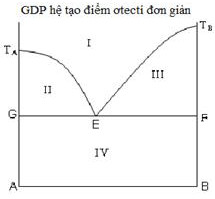
1) Hệ tại E, tùy theo cách điều chỉnh nhiệt độ ta có thể thu được A tinh khiết hoặc B tinh khiết.
2) Hệ tại E có bậc tự do bằng 0 (hệ vô biến).
3) Quá trình tại E xảy ra ở nhiệt độ không đổi vì lượng nhiệt phát ra khi kết tinh đã bù trừ cho lượng nhiệt của hệ mất đi khi làm lạnh.
4) Nhiệt độ tại E có giá trị cao nhất trong các nhiệt độ bắt đầu kết tinh của các hỗn hợp A – B khác nhau.
A. 1, 2
B. 2, 3
C. 3, 4
D. 1, 4
-
Câu 41:
Chọn đáp án sai:
A. Hệ có số bậc tự do bằng 0, tập hợp các pha trong hệ có dạng hình học là một đường thẳng.
B. Hệ có số bậc tự do bằng 0, tập hợp các pha trong hệ có dạng hình học là một điểm.
C. Hệ có số bậc tự do bằng 1, tập hợp các pha trong hệ có dạng hình học là một đường thẳng.
D. Hệ có số bậc tự do bằng 2, tập hợp các pha trong hệ có dạng hình học là một mặt phẳng.
-
Câu 42:
Trong giản đồ pha sau, có bao nhiêu điểm ơtecti:
A. 1
B. 2
C. 3
D. 4
-
Câu 43:
Trong giản đồ sau có các vùng I, II, III, IV, V. Hãy xác định vùng kết tinh của rắn A.

A. Vùng III
B. Vùng I
C. Vùng IV
D. Vùng II
-
Câu 44:
Chọn phương án đúng: Số pha của hệ phản ứng: BaSO4(r) ⇌ BaO(r) + SO2(k) + O2(k) là:
A. 3
B. 2
C. 1
D. 4
-
Câu 45:
Chọn phương án đúng: Xét hệ cân bằng gồm ba chất có mặt trong phản ứng sau: CaCO3(r) ⇌ CaO(r) + CO2(k):
A. Hệ có số cấu tử là 2, số pha là 2, số bậc tự do là 2
B. Hệ có số cấu tử là 2, số pha là 3, số bậc tự do là 1
C. Hệ có số cấu tử là 3, số pha là 3, số bậc tự do là 2
D. Hệ có số cấu tử là 3, số pha là 3, số bậc tự do là 1














