850 câu trắc nghiệm môn Hóa học đại cương
Nhằm giúp các bạn ôn tập và hệ thống lại kiến thức nhanh chóng để đạt kết quả cao trong kì thi sắp tới, tracnghiem.net tổng hợp và chia sẻ đến các bạn 850 câu trắc nghiệm môn Hóa học đại cương, bao gồm các kiến thức tổng quan về các định luật và khái niệm cơ bản về hóa học, cấu tạo nguyên tử, bảng hệ thống tuần hoàn, liên kết hóa học, hiệu ứng nhiệt của các quá trình hóa học,cân bằng hóa học và mức độ diễn ra các quá trình hóa học,... Hi vọng sẽ trở thành nguồn tài liệu bổ ích giúp các bạn học tập và nghiên cứu một cách tốt nhất. Để ôn tập hiệu quả các bạn có thể ôn theo từng phần trong bộ câu hỏi này bằng cách trả lời các câu hỏi và xem lại đáp án và lời giải chi tiết. Sau đó các bạn hãy chọn mục "Thi thử" để hệ thống lại kiến thức đã ôn. Chúc các bạn thành công với bộ đề "Cực Hot" này nhé!
Chọn hình thức trắc nghiệm (45 câu/50 phút)
Chọn phần
-
Câu 1:
Tính nhiệt tạo thành tiêu chuẩn của khí Freon-12: CCl2F2(k) từ các dữ kiện cho sau: Nhiệt thăng hoa của C(gr) là 716,7 kJ/mol. Năng lượng liên kết Cl–Cl ; F–F ; C–Cl ; C–F lần lượt là: 243,4 ; 158 ; 328 ; 441 (kJ/mol).
A. - 420 kJ/mol
B. - 477 kJ/mol
C. - 560 kJ/mol
D. - 467 kJ/mol
-
Câu 2:
Chọn phương án đúng: Quá trình chuyển pha lỏng thành pha rắn của brom có:
A. DH < 0, DS < 0, DV > 0
B. DH < 0, DS <0, DV < 0
C. DH > 0, DS < 0, DV < 0
D. DH > 0, DS > 0, DV > 0
-
Câu 3:
Chọn câu đúng. Quá trình hoà tan khí HCl trong nước xảy ra kèm theo sự thay đổi entropi chuyển pha (DScp) và entropi solvat hóa (DSs) như sau:
A. DScp < 0 , DSs > 0
B. DScp > 0 , DSs < 0
C. DScp > 0 , DSs > 0
D. DScp < 0 , DSs < 0
-
Câu 4:
Chọn phương án đúng: Phản ứng: Mg(r) + ½ O2(k) ® MgO(r) là phản ứng tỏa nhiệt mạnh. Xét dấu DHo, DSo, DGo của phản ứng này ở 25oC:
A. DHo < 0; DSo < 0 ; DGo < 0
B. DHo > 0; DSo > 0 ; DGo > 0
C. DHo < 0; DSo > 0 ; DGo > 0
D. DHo > 0; DSo > 0 ; DGo < 0
-
Câu 5:
Chọn so sánh đúng về entropi các chất sau: (1) \(S_{{H_2}O(l)}^0 > S_{_{{H_2}O(k)}}^0\) ; (2) \(S_{MgO(r)}^0 < S_{BaO(r)}^0\) ; (3) \(S_{{C_3}{H_3}(k)}^0 > S_{C{H_4}(k)}^0\) ; (4) \(S_{Fe(r)}^0 < S_{{H_2}(k)}^0\) ; (5) \(S_{Ca(r)}^0 > S_{{C_3}{H_3}(k)}^0\) ; (6) \(S_{S(r)}^0 < S_{S(l)}^0\).
A. 1, 2, 3, 4
B. 2, 3, 6
C. 1, 2, 3, 5, 6
D. 2, 3, 4, 6
-
Câu 6:
Chọn phát biểu sai trong các câu sau:
A. Phân tử càng phức tạp thì entropi càng lớn.
B. Entropi của các chất tăng khi áp suất tăng.
C. Entropi của các chất tăng khi nhiệt độ tăng.
D. Entropi là thước đo xác suất trạng thái của hệ.
-
Câu 7:
Chọn phương án đúng: Xác định quá trình nào sau đây có DS < 0.
A. N2(k, 25oC, 1atm) ® N2 (k, 0oC, 1atm)
B. O2 (k) ® 2O (k)
C. 2CH4(k) + 3O2(k) ® 2CO(k) + 4H2O(k)
D. NH4Cl (r) ® NH3 (k) + HCl (k)
-
Câu 8:
Chọn câu đúng. Phản ứng: 2A(r) + B(ℓ) = 2C(r) + D(ℓ) có:
A. DS = 0
B. DS » 0
C. DS > 0
D. DS < 0
-
Câu 9:
Chọn phương án đúng: Phản ứng: 2A(k) + B(k) = 3C(r) + D(k) có:
A. DS < 0
B. DS = 0
C. DS > 0
D. Không dự đoán được dấu của DS
-
Câu 10:
Chọn phát biểu đúng: Biến đổi entropi khi đi từ trạng thái A sang trạng thái B bằng 5 con đường khác nhau (xem giản đồ) có đặc tính sau:
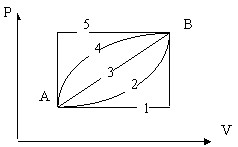
A. Mỗi con đường có DS khác nhau.
B. DS giống nhau cho cả 5 đường.
C. Không so sánh được.
D. DS của đường 3 nhỏ nhất vì là con đường ngắn nhất.
-
Câu 11:
Tính giá trị biến đổi DS khi 1 mol hơi nước ngưng tụ thành nước lỏng ở 100°C, 1 atm. Biết nhiệt bay hơi của nước ở nhiệt độ trên là 549 cal/g.
A. DS = 26,4 cal/mol.K
B. DS = -26,4 cal/mol.K
C. DS = 1,44 cal/mol.K
D. DS = -1,44 cal/mol.K
-
Câu 12:
Chọn phương án đúng: 1) Có thể kết luận ngay là phản ứng không tự xảy ra khi DG của phản ứng dương tại điều kiện đang xét. 2) Có thể căn cứ vào hiệu ứng nhiệt để dự đoán khả năng tự phát của phản ứng ở nhiệt độ thường. 3) Ở » 1000K, khả năng tự phát của phản ứng hóa học không phụ thuộc vào giá trị biến thiên enthanpy của phản ứng đó. 4) Nhiệt tạo thành tiêu chuẩn của một chất hóa học là một đại lượng không đổi ở giá trị nhiệt độ xác định.
A. 1, 2, 3
B. 1, 2, 3, 4
C. 1, 2, 4
D. 2, 4
-
Câu 13:
Chọn câu đúng. Phản ứng thu nhiệt mạnh:
A. Không thể xảy ra tự phát ở mọi nhiệt độ nếu biến thiên entropi của nó dương.
B. Có thể xảy ra tự phát ở nhiệt độ thấp.
C. Có thể xảy ra tự phát ở nhiệt độ cao nếu biến thiên entropi của nó âm.
D. Có thể xảy ra tự phát ở nhiệt độ cao nếu biến thiên entropi của nó dương.
-
Câu 14:
Chọn phương án đúng: Phản ứng 3O2(k) ® 2O3(k) ở điều kiện tiêu chuẩn có \(\Delta H_{298}^0\) = 284,4 kJ, \(\Delta S_{298}^0\) = -139,8 J/K. Biết rằng biến thiên entanpi và biến thiên entropi của phản ứng ít biến đổi theo nhiệt độ. Vậy phát biểu nào dưới đây là phù hợp với quá trình phản ứng:
A. Phản ứng không xảy ra tự phát ở mọi nhiệt độ.
B. Ở nhiệt độ cao, phản ứng diễn ra tự phát.
C. Ở nhiệt độ thấp, phản ứng diễn ra tự phát.
D. Phản ứng xảy ra tự phát ở mọi nhiệt độ.
-
Câu 15:
Chọn câu phù hợp nhất. Cho phản ứng 2Mg (r) + CO2 (k) = 2MgO (r) + Cgraphit. Phản ứng này có hiệu ứng nhiệt tiêu chuẩn \(\Delta H_{298}^0\) = -822,7 kJ , \(\Delta S_{298}^0\) = -219,35J/K. Về phương diện nhiệt động hóa học, phản ứng trên có thể: (Cho biết so với các chất trong phản ứng, MgO là chất có nhiệt độ nóng chảy cao nhất là 2800°C)
A. Không xảy ra tự phát ở nhiệt độ cao.
B. Xảy ra tự phát ở nhiệt độ cao.
C. Xảy ra tự phát ở nhiệt độ thấp.
D. Xảy ra tự phát ở mọi nhiệt độ.
-
Câu 16:
Chọn đáp án đầy đủ: Một phản ứng có thể tự xảy ra khi: (1) DH < 0 rất âm, DS < 0, nhiệt độ thường. (2) DH < 0, DS > 0. (3) DH > 0 rất lớn, DS > 0, nhiệt độ thường. (4) DH > 0, DS > 0, nhiệt độ cao.
A. 1 và 2 đúng
B. 1 và 3 đúng
C. 1, 2 và 4 đúng
D. 2 và 4 đúng
-
Câu 17:
Chọn một phát biểu sai:
A. Một phản ứng thu nhiệt mạnh nhưng làm tăng entropi có thể xảy ra tự phát ở nhiệt độ thường.
B. Một phản ứng tỏa nhiệt mạnh có thể xảy ra tự phát ở nhiệt độ thường.
C. Một phản ứng thu nhiệt mạnh và biến thiên entropi dương chỉ có thể xảy ra tự phát ở nhiệt độ cao.
D. Một phản ứng hầu như không thu hay phát nhiệt nhưng làm tăng entropi có thể xảy ra tự phát ở nhiệt độ thường.
-
Câu 18:
Chọn câu trả lời đúng. Một phản ứng ở điều kiện đang xét có DG < 0 thì:
A. xảy ra tự phát trong thực tế.
B. có khả năng xảy ra tự phát trong thực tế.
C. ở trạng thái cân bằng.
D. không xảy ra.
-
Câu 19:
Chọn đáp án đầy đủ nhất. Phản ứng có thể xảy ra tự phát trong các trường hợp sau:
A. DH < 0; DS < 0; DH > 0; DS > 0; DH > 0; DS < 0
B. DH > 0; DS < 0; DH < 0; DS > 0; DH < 0; DS < 0
C. DH > 0; DS > 0; DH < 0; DS < 0; DH < 0; DS > 0
D. DH < 0; DS > 0; DH > 0; DS > 0; DH > 0; DS < 0
-
Câu 20:
Chọn trường hợp sai: Tiêu chuẩn có thể cho biết phản ứng có thể xảy ra tự phát được về mặt nhiệt động là:
A. Công chống áp suất ngoài A > 0
B. DH° < 0, DS° > 0
C. DG° < 0
D. Hằng số cân bằng K lớn hơn 1
-
Câu 21:
Chọn một phát biểu sai.
A. Tất cả các quá trình bất thuận nghịch trong tự nhiên là quá trình tự xảy ra.
B. Ở điều kiện bình thường, các quá trình toả nhiều nhiệt là quá trình có khả năng tự xảy ra.
C. Tất cả các quá trình sinh công có ích là quá trình tự xảy ra.
D. Tất cả các quá trình kèm theo sự tăng độ hỗn loạn của hệ bất kỳ là quá trình tự xảy ra.
-
Câu 22:
Chọn phát biểu đúng và đầy đủ. (1) Đa số các phản ứng xảy ra ở nhiệt độ cao có biến thiên entropi dương. (2) Phản ứng không thể xảy ra tự phát ở mọi điều kiện khi \(\Delta G_{pu}^0\) > 0. (3) Một phản ứng thu nhiệt mạnh nhưng làm tăng entropi có thể xảy ra tự phát ở nhiệt độ thường. (4) Có thể kết luận ngay là phản ứng không xảy ra tự phát khi DG của phản ứng này lớn hơn không tại điều kiện đang xét.
A. 1 và 4
B. 1, 2, 3 và 4
C. 1, 2 và 4
D. 1, 3 và 4
-
Câu 23:
Chọn phương án đúng: Cho các phản ứng xảy ra ở điều kiện tiêu chuẩn:
1) 3O2(k) ® 2O3(k), DH° > 0, phản ứng không xảy ra tự phát ở mọi nhiệt độ.
2) C4H8(k) + 6O2(k) ® 4CO2(k) + 4H2O(k), DH° < 0, phản ứng xảy ra tự phát ở mọi nhiệt độ.
3) CaCO3(r) ® CaO(r) + CO2(k), DH° > 0, phản ứng xảy ra tự phát ở nhiệt độ cao.
4) SO2(k) + ½ O2(k) ® SO3(k), DH° < 0, phản ứng xảy ra tự phát ở nhiệt độ thấp.
A. 1, 3, 4
B. 2, 4
C. 1, 2, 3, 4
D. 1, 3
-
Câu 24:
Chọn phát biểu đúng: Tính DS° (J/K) ở 25oC của phản ứng: SO2 (k) + ½ O2 (k) = SO3 (k). Cho biết entropi tiêu chuẩn ở 25°C của các chất SO2(k), O2(k) và SO3(k) lần lượt bằng: 248 , 205 và 257 (J/mol.K).
A. 196
B. – 93,5
C. – 196
D. 93,5
-
Câu 25:
Chọn đáp án đúng và đầy đủ nhất: Một phản ứng có DG298 > 0. Những biện pháp nào khi áp dụng có thể làm phản ứng xảy ra được: (1) Dùng xúc tác ; (2) Thay đổi nhiệt độ ; (3) Tăng nồng độ tác chất ; (4) Nghiền nhỏ các tác chất rắn.
A. 3, 4
B. 1, 3, 4
C. 2, 3
D. 1, 2, 3, 4
-
Câu 26:
Chọn phương án đúng: Ở một điều kiện xác định, phản ứng A ® B thu nhiệt mạnh có thể tiến hành đến cùng. Có thể rút ra các kết luận sau: (1) DSpư > 0 và nhiệt độ tiến hành phản ứng phải đủ cao. (2) Phản ứng B ® A ở cùng điều kiện có DGpư > 0. (3) Phản ứng B ® A có thể tiến hành ở nhiệt độ thấp và có DSpư < 0.
A. 2
B. 3
C. 1
D. 1, 2, 3
-
Câu 27:
Chọn trường hợp đúng: Biết rằng ở 0°C quá trình nóng chảy của nước đá ở áp suất khí quyển có DG = 0. Vậy ở 383K quá trình nóng chảy của nước đá ở áp suất này có dấu của DG là:
A. DG > 0
B. DG < 0
C. DG = 0
D. Không xác định được vì còn yếu tố khác
-
Câu 28:
Chọn phương án đúng: Phản ứng CaCO3 (r) ® CaO (r) + CO2 (k) là phản ứng thu nhiệt mạnh. Xét dấu DH°, DS°, DG° của phản ứng này ở 25°C:
A. DH° > 0; DS° > 0; DG° > 0
B. DH° < 0; DS° < 0; DG° < 0
C. DH° < 0; DS° > 0; DG° > 0
D. DH° > 0; DS° > 0; DG° < 0
-
Câu 29:
Chọn phương án đúng: Phản ứng H2O2 (ℓ) ® H2O (ℓ) + ½ O2 (k) tỏa nhiệt, vậy phản ứng này có:
A. DH > 0; DS < 0 ; DG < 0 có thể xảy ra tự phát ở nhiệt độ thường.
B. DH > 0; DS > 0 ; DG > 0 không thể xảy ra tự phát ở nhiệt độ thường.
C. DH < 0; DS > 0 ; DG < 0 có thể xảy ra tự phát ở nhiệt độ thường.
D. DH < 0; DS > 0 ; DG > 0 không thể xảy ra tự phát ở nhiệt độ thường.
-
Câu 30:
Chọn trường hợp đúng. Căn cứ trên dấu \(\Delta G_{298}^0\) của 2 phản ứng sau:
PbO2 (r) + Pb (r) = 2PbO (r) \(\Delta G_{298}^0\) < 0
SnO2 (r) + Sn (r) = 2SnO (r) \(\Delta G_{298}^0\) > 0
Trạng thái oxy hóa dương bền hơn đối với các kim loại chì và thiếc là:
A. Chì (+4), thiếc (+2)
B. Chì (+2), thiếc (+4)
C. Chì (+4), thiếc (+4)
D. Chì (+2), thiếc (+2)
-
Câu 31:
Chọn những câu đúng: Về phương diện nhiệt động hóa học:
1) Đa số phản ứng có thể xảy ra tự phát hoàn toàn khi \(\Delta G_{pu}^0\) < -40 kJ.
2) Phản ứng không xảy ra tự phát trong thực tế khi \(\Delta G_{pu}^0\) > 40 kJ.
3) Phản ứng không xảy ra tự phát trong thực tế khi \(\Delta G_{pu}^0\) > 0.
4) Đa số các phản ứng có thế đẳng áp tiêu chuẩn nằm trong khoảng -40 kJ < \(\Delta G_{pu}^0\) < 40 kJ xảy ra tự phát thuận nghịch trong thực tế.
A. 1, 3
B. 3, 4
C. 1, 2, 4
D. 1, 2, 3, 4
-
Câu 32:
Chọn phát biểu đúng: Đối với phản ứng một chiều, tốc độ phản ứng sẽ:
A. Giảm dần theo thời gian cho đến khi bằng không.
B. Không đổi theo thời gian.
C. Giảm dần theo thời gian cho đến khi bằng một hằng số khác không.
D. Tăng dần theo thời gian.
-
Câu 33:
Chọn phát biểu đúng. Phản ứng thuận nghịch là: (1) Phản ứng có thể xảy ra theo chiều thuận hay theo chiều nghịch tùy điều kiện phản ứng. (2) Phản ứng xảy ra đồng thời theo hai chiều ngược nhau trong cùng một điều kiện. (3) Phản ứng tự xảy ra cho đến khi hết các chất phản ứng.
A. 1
B. 2
C. 3
D. 1 và 2
-
Câu 34:
Chọn phát biểu đúng về hệ cân bằng:
A. Hệ cân bằng là hệ trong đó có tỉ lệ thành phần các chất không thay đổi khi ta thay đổi các điều kiện khác.
B. Hệ đang ở trạng thái cân bằng là hệ có các giá trị thông số trạng thái (nhiệt độ, áp suất, nồng độ,…) không thay đổi theo thời gian.
C. Hệ cân bằng là hệ có nhiệt độ và áp suất xác định.
D. Hệ cân bằng là hệ có nồng độ tất cả các chất đều bằng nhau.
-
Câu 35:
Kết luận nào dưới đây là đúng khi một phản ứng thuận nghịch có DG° < 0:
A. Hằng số cân bằng của phản ứng lớn hơn 0.
B. Hằng số cân bằng của phản ứng nhỏ hơn 1.
C. Hằng số cân bằng của phản ứng lớn hơn 1.
D. Hằng số cân bằng của phản ứng nhỏ hơn 0.
-
Câu 36:
Cho phản ứng aA (l) + bB (k) ⇌ cC (k) + dD (l), có hằng số cân bằng Kc. Chọn phát biểu đúng: (1) DG = DG° + RTlnKc , khi DG = 0 thì DG° = -RTlnKc. (2) Hằng số cân bằng Kc tính bằng biểu thức: \({K_c} = \frac{{C_c^C.C_D^d}}{{C_A^a.C_B^b}}\), Với CA, CB , CC và CD là nồng độ các chất tại lúc đang xét. (3) Phản ứng luôn có KP = KC(RT)Dn với Dn = Snsp-Sncđ của tất cả các chất không phụ thuộc vào trạng thái tồn tại của chúng.
A. 1
B. 2
C. 3
D. Không có phát biểu nào chính xác
-
Câu 37:
Giả sử hệ đang ở cân bằng, phản ứng nào sau đây được coi là đã xảy ra hoàn toàn:
A. FeO (r) + CO (k) = Fe (r) + CO2 (k) KCb = 0,403
B. 2C (r) + O2 (k) = 2CO (k) KCb = 1 ×1016
C. 2Cl2 (k) + 2 H2O (k) = 4 HCl (k) + O2 (k) KCb = 1,88 × 10-15
D. CH3CH2CH2CH3 (k) = CH3CH(CH3)2 (k) KCb = 2,5
-
Câu 38:
Cho một phản ứng thuận nghịch trong dung dịch lỏng A + B ⇌ C + D. Hằng số cân bằng Kc ở điều kiện cho trước bằng 200. Một hỗn hợp có nồng độ CA = CB = 10-3M, CC = CD = 0,01M. Trạng thái của hệ ở điều kiện này:
A. Hệ đang dịch chuyển theo chiều nghịch.
B. Hệ nằm ở trạng thái cân bằng.
C. Hệ đang dịch chuyển theo chiều thuận.
D. Không thể dự đoán được trạng thái của phản ứng.
-
Câu 39:
Phản ứng CaCO3 (r) ⇌ CaO (r) + CO2 (k) có hằng số cân bằng Kp = PCO2. Áp suất hơi của CaCO3, CaO không có mặt trong biểu thức Kp vì:
A. Có thể xem áp suất hơi của CaCO3 và CaO bằng 1 atm.
B. Áp suất hơi của chất rắn không đáng kể.
C. Áp suất hơi của CaCO3 và CaO là hằng số ở nhiệt độ xác định.
D. Áp suất hơi chất rắn không phụ thuộc vào nhiệt độ.
-
Câu 40:
Chọn phương án đúng: Phản ứng C(gr) + CO2 (k) ⇌ 2CO(k) ở 815°C có hằng số cân bằng Kp = 10. Tại trạng thái cân bằng, áp suất chung của hệ là P = 1atm. Hãy tính áp suất riêng phần của CO tại cân bằng.
A. 0,85 atm
B. 0,72 atm
C. 0,68atm
D. 0,92 atm
-
Câu 41:
Chọn phát biểu đúng: cho phản ứng A (dd) + B (dd) ⇌ C(dd) + D (dd). Nồng độ ban đầu của mỗi chất A, B, C, D là 1,5 mol/l. Sau khi cân bằng được thiết lập, nồng độ của C là 2 mol/l. Hằng số cân bằng Kc của hệ này là:
A. 0,25
B. 1,5
C. 4
D. 2,0
-
Câu 42:
Chọn phương án đúng: Xác định công thức đúng để tính hằng số cân bằng KP của phản ứng: Fe3O4(r) + 4CO(k) ⇌ 3Fe(r) + 4CO2(k).
A. \({K_p} = {\left( {\frac{{P_{C{O_2}}^4{{\left[ {Fe} \right]}^3}}}{{P_{CO}^4\left[ {F{e_3}{O_4}} \right]}}} \right)_{cb}}\)
B. \({K_p} = {\left( {\frac{{{{\left[ {Fe} \right]}^3}{{\left[ {C{O_2}} \right]}^4}}}{{\left[ {F{e_3}{O_4}} \right]{{\left[ {CO} \right]}^4}}}} \right)_{cb}}\)
C. \({K_p} = {\left( {\frac{{P_{C{O_2}}^4}}{{P_{CO}^4}}} \right)_{cb}}\)
D. \({K_p} = {\left( {\frac{{{P_{C{O_2}}}}}{{{P_{CO}}}}} \right)_{cb}}\)
-
Câu 43:
Xác định công thức đúng để tính hằng số cân bằng KC của phản ứng: SCl2(dd) + H2O(ℓ) ⇌ 2HCl(dd) + SO(dd)
A. \(K = {\left( {\frac{{{{\left[ {HCl} \right]}^2}\left[ {SO} \right]}}{{\left[ {SC{l_2}} \right]}}} \right)_{cb}}\)
B. \(K = {\left( {\frac{{\left[ {SC{l_2}} \right]\left[ {{H_2}O} \right]}}{{\left[ {HCl} \right]\left[ {SO} \right]}}} \right)_{cb}}\)
C. \(K = {\left( {\frac{{\left[ {HCl} \right]\left[ {SO} \right]}}{{\left[ {SC{l_2}} \right]\left[ {{H_2}O} \right]}}} \right)_{cb}}\)
D. \(K = {\left( {\frac{{{{\left[ {HCl} \right]}^2}\left[ {SO} \right]}}{{\left[ {SC{l_2}} \right]\left[ {{H_2}O} \right]}}} \right)_{cb}}\)
-
Câu 44:
Chọn phát biểu đúng: Phản ứng H2 (k) + ½ O2 (k) ⇌ H2O (k) có \(DG_{298}^0\) = -54,64 kcal. Tính Kp ở điều kiện tiêu chuẩn. Cho R = 1,987 cal/mol.K.
A. Kp = 40,1
B. Kp = 1040,1
C. Kp = 1092,3
D. Kp = 92,3
-
Câu 45:
Ở một nhiệt độ xác định, phản ứng: S (r) + O2 (k) ⇌ SO2 (k) có hằng số cân bằng KC = 4,2×1052. Tính hằng số cân bằng K’C của phản ứng SO2 (k) ⇌ S (r) + O2 (k) ở cùng nhiệt độ.
A. 2,38 × 1053
B. 4,2 × 10-52
C. 4,2 × 10-54
D. 2,38 × 10-53














